A ciência moderna mudou o mundo com a quantidade de informações, descobertas, invenções e estudos que os cientistas, até então por muito tempo limitados pelo peso da mãe católica, puderam fazer com mais liberdade após a Reforma Protestante.
As descobertas não só encheram livros nas bibliotecas, mas também contribuíram para novos cálculos, raciocínios, entendimentos da dinâmica do mundo e proporcionaram a partir disso, a invenção de centenas de máquinas e objetos essenciais para a nossa vida atualmente.
Apesar de muito do que vivemos hoje ser creditado a essa ciência moderna, transformadora e avassaladora que iluminou principalmente o século XIX, muitos dos conceitos “científicos” foram adquiridos de estudos mais antigos de outras civilizações da Europa, da Mesopotâmia e do Oriente.
O Átomo
Antes mesmo da ciência moderna começar a pensar sobre essa problemática, os antigos gregos já admitiam que as coisas eram constituídas por pequenas partes indivisíveis. Essas pequenas partes receberam o nome de “átomo” que se traduzido literalmente, ficaria “indivisível”.
Essa teoria foi estudada na modernidade e em 1803, um cientista inglês chamado John Dalton o constatou em seus escritos que até a menor parte visível era composta de centenas de aglomerados atômicos menores de matéria. A descoberta da radioatividade também contribuiria para os estudos atômicos.
Outros cientistas passaram a admitir cargas elétricas aos átomos por meio de experimentos. A matéria, apesar de neutra, era eletricamente carregada, e isso só poderia se mostrar por meio da quebra atômica. A partir daí, o Átomo passa a ser considerada divisível e também possuindo partículas ainda menores a atividade.
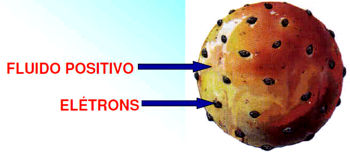
Em meio a esses estudos, foi proposto o famoso modelo do “pudim de passas” em 1904, no qual o átomo era representado de maciça, com diversos outros elementos carregados a seu redor. Esse modelo foi derrubado com os experimentos de Rutherford em 1911.
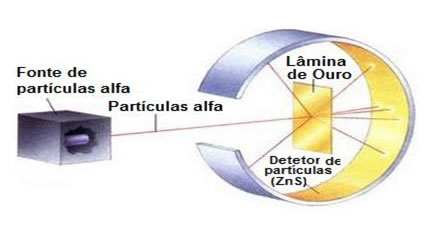
Com um experimento bastante peculiar, Rutherford chegou a conclusão que os átomos eram eletrificados positivamente e que ao seu redor, partículas de cargas positivas giravam para contrabalancear a carga, deixando a matéria neutra. Essas partículas receberam o nome de elétrons.
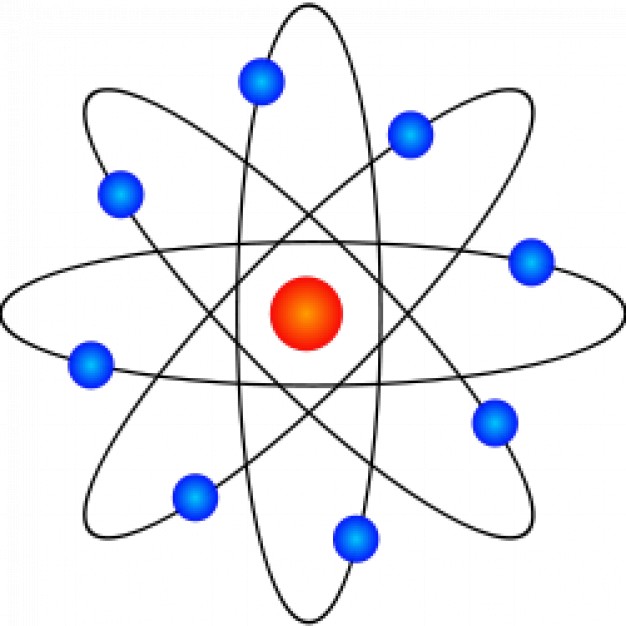
Analisando a incidência de diferentes cores de luz, o cientista alemão Bohr, em 1913, especulou que os elétrons emitissem cargas elétricas eletromagnéticas quando transitavam de uma órbita para outra. Dessa forma, Bohr estabeleceu que os átomos possuem diferentes níveis de órbitas onde transitam os elétrons e nêutrons também.
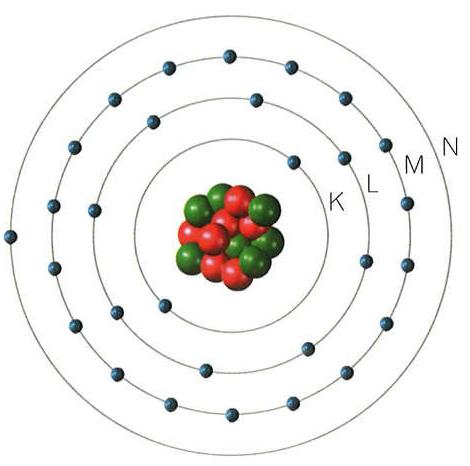
Heisenberg viria substituir esse modelo pelo sistema orbital e o pelo princípio da incerteza, alegando a impossibilidade de se calcular a velocidade e localização de um elétron.
Atualmente, os estudos atômicos já nos mostram resultados bastante satisfatórios no posicionamento dos elétrons. O modelo atômico das orbitais é aceito até hoje e diversas invenções foram produzidas com os conhecimentos atômicos.
