Mesmo com avanço nos estudos científicos da química, as forças que determinam as famosas ligações químicas ainda são um assunto intrigante e fazem parte de muitos projetos de pesquisas. Basicamente, essas ligações são responsáveis pela afinidade e atração entre os átomos, resultando na formação das moléculas.
Para que a interação entre diferentes átomos ocorra, as forças de ligações químicas utilizam-se da doação, do compartilhamento e até da reconfiguração dos elétrons entre si. Deste modo, existem no conhecimento químico três formas de ligações que podemos estudar, a iônica, covalente e a metálica.
Ligação iônica
A ligação iônica predomina no sentido de atrair, como força eletrostática, a incidência no dinamismo do íons de cargas opostas. Geralmente, essa ligação é caracterizada pela interação de um átomo metálico com um átomo não metálico, onde o metálico doa elétrons e o não metálico os recebe.
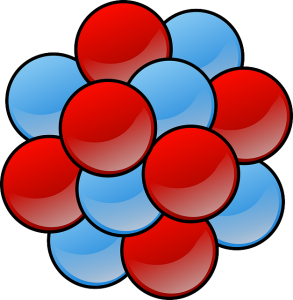
Normalmente, os compostos resultantes das ligações iônicos possuem pontos de ebulição e fusão bem altos, podendo ser quebradiços ou duros em sua solidez.
Ligação covalente
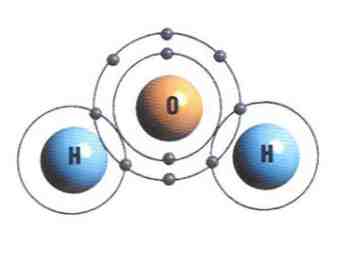
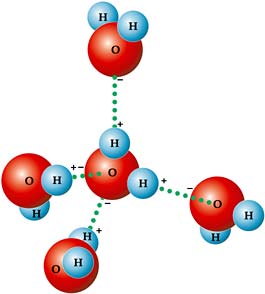
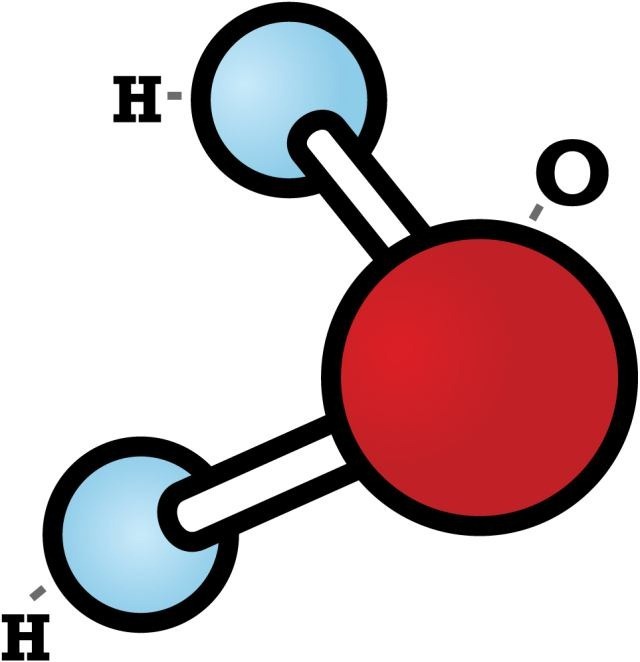
A ligação covalente pode ser caracterizada por envolver somente átomos não metálicos e hidrogênio. Esses átomos, podendo ser diferentes ou iguais, possuem a mesma facilidade em doar ou perder elétrons, fazendo com que a ligação se baseie em um sistema de compartilhamento de elétrons.
Devido ao estado de equilíbrio proporcionado pelo compartilhamento de elétrons entre os átomos, os compostos covalentes são elétricamente neutros, pois não perdem nem ganham mais elétrons.
Ligação metálica
O metais são elementos bastante particulares na natureza, normalmente tendo especificações como alto ponto de ebulição e fusão, solidez bastante robusta e alta condutividade elétrica. O que mantém essas características nesse sentido são as ligações metálicas, que aproximam ainda mais as moléculas desses elementos.
As ligações metálicas ocorrem na medida em que a ordenação das estruturas metálicas, geralmente muito juntas, cristalizadas e unitárias, permitem a circulação livre dos elétrons na camada de valência. Essa característica permite uma maior condutividade elétrica e térmica para as ligas metálicas e metais puros.